TEORÍA CINÉTICA DE LOS GASES
La Teoría Cinético Molecular de los gases es un conjunto de proposiciones que tratan de conseguir la estructura interior de los gases, con la finalidad de explicar el comportamiento cualitativo y cuantitativo de los mismos.
GAS IDEAL.- Es aquel gas que tiene el mismo comportamiento simple en todas las condiciones. A un gas ideal se le hacen dos descripciones:
a) Descripción macroscópica
b) Descripción microscópica
a) DESCRIPCIÓN MACROSCÓPICA.- Cuando un gas se encuentra a densidades suficientemente bajas, sin tomar en cuenta su composición química tienden a mostrar una cierta relación sencilla entre las variables: PRESIÓN, VOLUMEN Y TEMPERATURA.
Durante una transformación puede variar dos de estas magnitudes permaneciendo constante la tercera.
b) DESCRIPCIÓN MICROSCÓPICA.- Se aceptan las siguientes hipótesis:
1. Todo Gas está formado de pequeñas partículas llamadas moléculas, las mismas que son idénticas cuando el gas está en estado estable.
2. Las moléculas se mueven al azar y chocan unas contra otras o con las paredes del recipiente que contiene al gas y sin pérdida de energía.
3. La masa del Gas es la masa total de sus moléculas.
4. El volumen de las moléculas es una fracción sumamente pequeña del volumen ocupada por el gas.
5. Las moléculas están en continuo movimiento a cualquier temperatura por encima de CERO ABSOLUTO.
6. La energía cinética promedio es proporcional a la temperatura absoluta del gas.
7. Volúmenes iguales de todos los gases en idénticas condiciones de Presión y Temperatura contienen el mismo número de moléculas. A esto se conoce como la Ley o Hipótesis de Avogadro.
Haciendo extensivo a los líquidos y sólidos se determinan que el número de moléculas contenidas en un MOL de cualquier sustancia es igual a 6,02x1023 moléculas (Numero de Avogadro NA).
UNIDADES DE LA DESCRIPCIÓN MACROSCÓPICA.- Las relaciones que se cumplen en esta descripción, han sido establecidas empleando las siguientes unidades:
1.- TEMPERATURA (T).- Se emplea la Escala Absoluta KELVIN, cuyo cero coincide con el CERO ABSOLUTO. La temperatura de fusión del agua corresponde a 273ºK y la de ebullición del agua corresponde a 373ºK.
El símbolo que representa a la Temperatura expresada en Grados KELVIN es “T”.
Para convertir los grados centígrados (ºC) a Grados Absolutos Kelvin (K) se utiliza la ecuación:
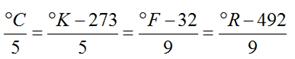
T = K= ºC + 273
2.- PRESIÓN (P).- La Presión de los gases se mide en Atmósferas, esta unidad tiene su equivalencia con la presión que ejerce una columna de mercurio.
1 atmósfera = 1013928 dinas/cm2 (cgs absoluto)
1 atmósfera = 1033,6 g-f/cm2 (cgs gravitatorio)
1 atmósfera = 760 mm Hg
Atmósferas = mm Hg/760
3.- VOLUMEN (V).-El volumen de los gases se mide en cm3, litros y m3.
1 litro = 1000c.c = 1000 ml
1m3 = 1000 litros
1 litro= 1dm3
LEY DE BOYLE- MARIOTTE.- “Siempre que la temperatura permanezca constante, los volúmenes que tienen los gases son inversamente proporcionales a las presiones que se ejercen sobre ellos.”
Esto indica que si la presión se duplica, triplica o cuadruplica, etc., el volumen del gas se hace 2, 3,4, etc., veces menor.
V α 1/P
V1.P1 = V2.P2
V1 = P2
V2 P1
Se puede esquematizar el comportamiento de una determinada cantidad de gas ideal a temperatura constante y sometida a variaciones de presión y volumen.
Trabajando con una masa constante de gas y a temperatura constante, tal como lo especifica la Ley de Boyle – Mariotte.
LEY DE CHARLES O LEY DE GAY LUSSAC.- “Si permanece constante la Presión, el volumen que ocupa un gas es directamente proporcional a su temperatura absoluta.”
V α T
Significa que si la temperatura se duplica, triplica, cuadruplica, etc., el volumen del gas también se duplica, triplica, etc...
V/P = constante
V1.T2 = T1.V2
V1 = V2
T1 T2
LEY O ECUACION GENERAL DE LOS GASES IDEALES
Esta Ley es consecuencia de la combinación de las dos anteriores y su expresión es:
V1.P1 = V2.P2 = k
T1 T2
Es decir 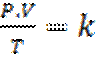
ECUACION DE ESTADO DE UN GAS IDEAL
Sí aplicamos dicha expresión para un mol de gas, el cual se encuentra en condiciones normales de presión y de temperatura, obtendremos el valor numérico de dicha constante de proporcionalidad.
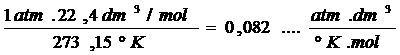
Por convención a la misma se la simboliza con la letra “R” en honor a HENRY REGNAULT y se la denomina como “Constante Universal de los Gases”.
![]()
Teniendo presente ambas igualdades se obtendrá la siguiente expresión para un mol de gas en condiciones normales de presión y de temperatura.
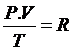
![]()
Para trabajar con un número determinado de moles; la expresión es la siguiente y se denomina “Ecuación General de los Gases”.
![]()
LEY de AVOGADRO.-VOLUMEN MOLAR DE UN GAS
“Volúmenes iguales de gases diferentes, sometidos a las mismas condiciones de temperatura y presión contienen el mismo número de moléculas” NA = 6.022 x 1023 mol-
Investigaciones experimentales demuestran que a la presión de una atmósfera y a 273 ºK (C.N.P.T), un mol de cualquier gas ocupa un volumen de 22,4 litros.
GASES REALES.- Son todos aquellos que existen en la naturaleza donde su comportamiento está influenciado por la existencia de fuerzas atractivas entre sus moléculas, esto hace que su comportamiento sea diferente al propuesto por la Teoría Cinética. Las fuerzas intermoleculares son de carácter electromagnético y tienen un comportamiento singular, porque cuando las moléculas se encuentran suficientemente próximas existe atracción, pero cuando se aproxima mucho esta fuerza se convierte en repulsión; este fenómeno es el que explica “el choque entre moléculas” y la resistencia reducir su volumen a cero (0).
CERO ABSOLUTO.- Es la temperatura más baja que se puede lograr y cuyo valor corresponde a -273.15ºC ó 0ºK. de la escala absoluta. Según la Teoría Cinética de los gases ideales, a esta temperatura el gas reduce su volumen a 0, pero esto es incorrecto porque si tomamos en cuenta las fuerzas intermoleculares, en el cero absoluto las moléculas del gas tienen la menor energía cinética posible.
EBULLICIÓN.- La ebullición de un líquido se produce cuando la presión exterior es igual a la presión máxima del vapor del líquido. La evaporación se produce tanto en el interior como en el exterior del líquido.
