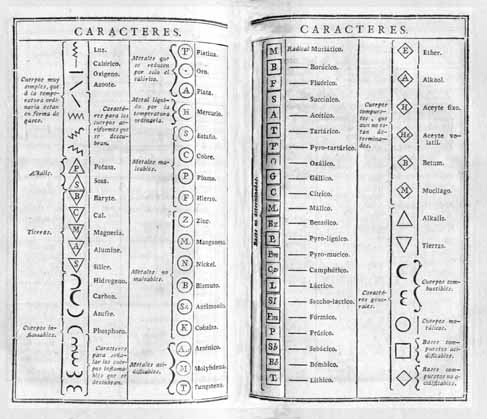
Símbolos químicos propuestos en el Méthode de nomenclature chimique.
Los trabajos terminólogicos de Guyton de Morveau y de otros autores del siglo XVIII culminaron con la publicación en 1787 de una importante obra firmada por cuatro importantes químicos franceses de ese período: Antoine Laurent Lavoisier, Antoine Fourcroy, Claude Louis Berthollet y el propio Guyton de Morveau. Su Méthode de nomenclature chimique contiene un conjunto sistemático de reglas para nombrar las substancias basado en las ideas químicas desarrolladas a finales del siglo XVIII que, entre otros aspectos, supusieron el abandono de la teoría del flogisto y la consolidación de nuevas ideas sobre la composición química.
Los cambios que ocurrieron en las explicaciones y en el lenguaje de la química, junto con el hecho de que fueran reconocidos como una revolución, tanto por los protagonistas como por autores posteriores, han llevado a historiadores de la ciencia como I. Bernard Cohen a afirmar que la "revolución química es un ejemplo paradigmático de una revolución en ciencia". De acuerdo con la interpretación más difundida, esta "revolución" consistió en el abandono de la teoría del flogisto y su reemplazamiento por una teoría sobre la combustión basada en la acción del oxígeno. El desarrollo de la química pneumática, que llevó al conocimiento de numerosos gases y al estudio de su papel en las reacciones químicas, y la introducción de la cuantificación en química, con el empleo sistemático de la balanza y la ley de conservación de la masa, fueron, de acuerdo con esta interpretación, las principales causas de esta crisis. Esta imagen tradicional de la revolución química ha sido discutida por numerosos autores que han matizado el carácter revolucionario de los cambios acontecidos en esos años, mostrando la existencia de una rica tradición de investigación en química durante el siglo XVIII, la cual no se encontraba centrada alrededor de los problemas que generalmente se asocian con la revolución química. Entre estas cuestiones se encuentran los estudios sobre las sales y la teoría de las afinidades, junto con las investigaciones sobre los principios activos de las substancias vegetales y animales que produjeron la aparición del análisis inmediato. Finalmente, también se ha mostrado la existencia de estudios cuantitativos en química mucho antes de la obra de Lavoisier .La balanza era un instrumento habitual en muchos laboratorios y, en algunos casos, como en los de ensayo de monedas, indispensable para el trabajo que allí se realizaba.
Los estudios históricos
también han puesto en cuestión la imagen tradicional acerca
de la teoría del flogisto. Lejos de ser un lastre para el avance
de la química, las ideas de Georg Ernst Stahl (1660-1734) inspiraron
el desarrollo de una explicación conjunta de fenómenos importantes
en aquel momento como la calcinación de los metales, la combustión
o la respiración. Los autores que defendían estas ideas consideraban
que substancias como el azufre, el carbón o los metales contenían
un principio ígneo, denominado flogisto, que les confería
su carácter combustible. La transformación del metal en cal
se explicaba por la pérdida del flogisto del primero, de modo que
el metal era considerado un compuesto de cal y flogisto. Resultaba también
fácil explicar mediante este esquema el proceso inverso -lo que
hoy denominamos reducción. Bastaba suponer que la adición
de una cantidad conveniente de flogisto a la cal permitía obtener
de nuevo el metal. Por ello, las substancias ricas en flogisto –como el
carbón vegetal- eran consideradas especialmente adecuadas para producir
estos procesos de obtención del metal, tal y como se podía
comprobar fácilmente en los laboratorios químicos de la época.
De modo semejante, esta teoría permitía la explicación
de otros procesos de combustión o la respiración de los animales.
Durante el siglo XVIII, la teoría del flogisto
fue empleada por diversos autores que introdujeron numerosas novedades
en los planteamientos de Stahl. Al mismo tiempo, se produjo el desarrollo
de la química pneumática, cuyo punto de partida puede situarse
en la obra de autores como Stephen Hales (1677-1761), que, entre otras
cuestiones, desarrolló nuevos métodos para la recolección
de gases y su estudio. Conviene recordar en este punto que el término
"gas" había sido acuñado por Jean-Baptiste van Helmont (1577-1644),
quien probablemente lo derivó de la palabra de origen griego "caos".
Aunque autores como van Helmont realizaron las primeras descripciones de
determinados gases, el papel químico de estas substancias fue investigado
por los químicos del siglo XVIII, que mostraron la existencia de
diversos tipos de "aires", con propiedades físicas y químicas
diferentes. De este modo, Joseph Black (1728-1799) utilizó la expresión
"fixed air" (aire fijo) para designar al que se desprendía
durante el calentamiento de la magnesia alba, un carbonato de
magnesio
que era empleado con fines terapéuticos. Por su parte, el farmacéutico
sueco Carl Wilhelm Scheele (1742-1786) acuñó el término
"Feuerluft" (aire de fuego) para designar a una substancia que más
adelante fue denominada oxígeno por Lavoisier. Otro autor que, trabajando
dentro del marco de la teoría del flogisto, realizó notables
contribuciones a la química pneumática fue el inglés
Joseph Priestley (1733-1804). Así, introdujo las expresiónes
"aire flogisticado" y "aire desflogisticado" para designar dos tipos de
aire con diferente comportamiento respecto a la combustión. En el
segundo, las substancias ardían con mayor facilidad que en el aire
común, mientras que el primero no podía mantener ni la combustión
ni la vida animal. Priestley interpretó estos comportamientos considerando
la cantidad de flogisto que contenía cada uno. El "aire flogisticado"
no podía mantener la combustión puesto que no podía
recoger el flogisto formado en ella, cosa que sí podía hacer,
incluso con mayor facilidad que el aire común, el que había
denominado "aire desflogisticado". Este ejemplo muestra las posibilidades
que ofrecía la teoría del flogisto para interpretar numerosos
fenómenos químicos, algunos de ellos conocidos después
de la formulación de esta teoría.
La teoría del flogisto, sin embargo, presentaba
un problema importante cuando se consideraban los pesos de las substancias
que participaban en las anteriores transformaciones. Esta cuestión
se convirtió en un argumento decisivo en manos de Antoine Lavoisier.
Si la formación de la cal se interpretaba como una separación
del flogisto del metal ¿cómo podía explicarse el hecho
-conocido desde mucho tiempo atrás- de que la cal pesara más
que el metal de partida?. Algunos autores propusieron la hipótesis
ad
hoc de un peso negativo del flogisto. Alrededor de 1772, Lavoisier
comenzó a elaborar y a defender la idea de que ese aumento de peso
se debía a la fijación de una parte del aire atmosférico
por parte del metal, de modo que se liberaba la materia del fuego o
calórico
y se formaba la cal correspondiente. Lavoisier denominó a esta parte
del aire atmosférico con el nombre de "principe acidifiant"
y, más tarde, "principe oxygine", puesto que lo consideraba
como el "principio" que confería el carácter ácido
a las substancias. Tras el descubrimiento de ácidos que no contenían
oxígeno, sobre todo con los experimentos electroquímicos
de Humphry Davy (1778-1829), las ideas de Lavoisier sobre la acidez fueron
abandonada, pero el término "oxígeno" se ha mantenido hasta
nuestros días.
En el marco de esta "revolución química"
se produjo la publicación del Méthode de nomenclature
chimique. La obra tenía como fundamento el nuevo concepto de
composición química que se consolidó a lo largo del
siglo XVIII, que ha sido ya tratado en el apartado anterior. El punto de
partida de la nueva nomenclatura lo constituyó la lista de substancias
simples elaborada por Lavoisier a partir de la conocida definición
que proponía "considerar como simples todas las substancias que
no se habían podido descomponer". Eliminado el flogisto del campo
de la química, los metales pasaron a formar parte de las substancias
simples mientras que la mayor parte de las cales pasaron a ser substancias
compuestas de un metal y oxígeno. No obstante, algunas substancias
como la cal o la magnesia, aparecieron dentro de la famosa lista de
treinta
y tres substancias simples que figuran en el Traité élémentaire
de chimie de Lavoisier, dado que no habían sido todavía
analizadas. La lista también incluía algunos "radicales"
como el "radical muriático", "radical fluórico" o "radical
borácico" puesto que Lavoisier pensaba que los correspondientes
ácidos no eran substancias simples sino formadas por estos radicales
y oxígeno, a pesar de que había sido imposible descomponerlas.
La distinción entre substancias simples y
compuestas permitió establecer nombres claramente diferentes para
ambos tipos de substancias. En el Méthode de nomenclature chimique
las
substancias simples son nombradas con un nombre único, sin dar mucha
importancia al criterio empleado para acuñar tal término.
En la lista de elementos propuesta por Lavoisier encontramos términos
formados según las propriedades químicas del elemento (oxígeno,
hidrógeno), otros acuñados a partir del nombre del mineral
de procedencia (tungsteno) e, incluso, nombres que procedían de
la tradición alquímica (mercurio). Los autores del Méthode
apenas prestaron atención a los nombres de los elementos, que, en
general, continuaron siendo los que habían sido empleados hasta
ese momento.
Todo lo contrario ocurrió con los términos
empleados para designar las substancias compuestas cuyo número era,
en ese momento, muy superior al de las substancias simples. Las
substancias
compuestas fueron designadas mediante nombres binarios, en los que se
utilizaban
las raíces de los nombres de los elementos para indicar su composición
química. De ese modo, una substancia que hasta la fecha había
sido designada con nombres como "tártaro vitriolado", "arcano duplicado"o
"sal policresta de Glaser" pasó a denominarse "sulfato de potasa",
término que hace referencia a las substancias que entran en su
composición.
Este método permitía no sólo la eliminación
de los múltiples sinónimos empleados para una misma substancia
sino también establecer un criterio único, la composición
química, para nombrar las substancias compuestas.
Otro problema que debieron solucionar los autores
de este Méthode fueron los términos empleados para
designar substancias compuestas con idénticos elementos pero presentes
en diferente proporción. En este caso, el empleo de términos
en los que se indicaban sólamente los elementos del compuesto no
era suficiente puesto que, bajo un mismo nombre, se ocultaban substancias
con propiedades químicas muy diversas. Por ejemplo, el empleo del
término "óxido de cobre", en el que sólo se indica
la composición química de este compuesto, es confuso puesto
que puede ser aplicado tanto a un sólido de color rojo como a un
polvo negro oxidante. Para solucionar este problema, los autores del
Méthode
introdujeron
diversos sufijos que informaban sobre la proporción de los elementos
en el compuesto. De este modo, propusieron el término "ácido
sulfúrico" para un compuesto de "azufre saturado de oxígeno"
y para sus sales el nombre genérico de "sulfatos". Por su parte,
el "ácido sulfuroso" designaba un compuesto de "azufre unido a una
cantidad menor de oxígeno"; sus sales se denominaron "sulfitos".
El Méthode de nomenclature chimique
fue recibido de diverso modo por los diferentes grupos interesados en la
química en cada uno de los países europeos. Algunos autores
llegaron incluso a elaborar una propuesta nueva para la reforma de la
nomenclara
química, como la que presentó en 1787 el profesor de química
de la Universidad de Louvain Karel van Brochaute. Por su parte, Joseph
Priestley (1733-1804), que nunca aceptó las nuevas ideas de Lavoisier
sobre la combustión, rechazó también la mayor parte
de los nuevos términos por considerar que estaban basados en "principios
... no suficientemente establecidos". No obstante, en la mayor parte de
los casos, la nueva nomenclatura fue aceptada con diversos matices, en
ocasiones por autores no claramente partidarios de las nuevas ideas sobre
la combustión defendidas por Lavoisier. Términos como "azote"
fueron rechazados por algunos autores y en su lugar se propuso el de
"nitrógeno",
que fue aceptado en diversas lenguas europeas. Los autores que tradujeron
esta terminología al castellano, inglés o italiano siguieron
el consejo de los autores del Méthode y adaptaron los términos
de origen griegos a su ortografía. Los traductores alemanes, por
el contrario, decidieron emplear raíces procedentes de su propia
lengua y ,de ese modo, acuñaron términos como "Sauerstoff
" o "Wasserstoff" que tienen un significado semejante a "oxígeno"
o "hidrógeno". De modo similar, para designar a estas sustancias,
los traductores suecos establecieron los términos "syre",
a partir de "syra" (ácido) y "väte", procedente
de "vatten" (agua), mientras que los traductores polacos acuñaron
"kwasorod", a partir de la palabra "kwas" (ácido),
y "wodorod", que contiene la raíz de woda (agua).
Aunque en otras lenguas el término "oxígeno" fue finalmente
aceptado, no faltaron críticas y nuevas propuestas para nombrar
a este elemento, como las que realizó el cirujano español
Juan Manuel de Aréjula (1755-1830) en sus Reflexiones sobre la
Nueva nomenclatura química, publicadas en 1788. Aréjula
puso en cuestión algunas ideas de Lavoisier sobre la acidez y propuso
el término "arxicayo" (principio de la combustión) para substituir
al de "oxígeno", que consideraba incorrecto.
Con diferentes modificaciones, las ideas del Méthode
de nomenclature chimique fueron aceptadas por la mayor parte de los
cultivadores de la química europeos. Su influencia sobre la terminología
química inorgánica ha sido enorme, no sólo porque
muchos de los nuevos términos acuñados en ese momento se
han mantenido prácticamente hasta nuestros días, sino también
por su influencia como método para nombrar las substancias. El empleo
de raíces que designan los elementos del compuesto y diversos sufijos
y prefijos que informan sobre la proporción relativa de esos elementos
continúa siendo la base de buena parte de la terminología
de la química inorgánica.

Símbolos químicos propuestos en el Méthode
de nomenclature chimique.
Estos símbolos fueron
diseñados por Jean Henri Hassenfratz (1755-1827) y Pierre Auguste
Adet (1763-1834). Su propuesta comenzaba con una crítica al estado
de confusión que habían producido los símbolos empleados
por los químicos hasta ese momento. Para estos autores, unos caracteres
químicos adecuados deberían diferenciar -como habían
hecho los autores de la nueva nomenclatura- entre substancias simples y
compuestas, y, estas últimas debían de representarse mediante
símbolos que indicaran "el número, la naturaleza, la relación
de cantidad de las substancias simples" que las formaban así como
"el modo en que estas substancias actúan unas sobre las otras".
Dado que Adet y Hassenfratz consideraban que no se disponía todavía
de suficiente información sobre este último punto, trataron
de buscar unos símbolos que expresaran adecuadamente las substancias
que forman los compuestos y que ofrecieran una indicación de la
proporción entre las cantidades que entran en combinación.
En primer lugar, establecieron símbolos para cada uno de los seis
grupos de substancias simples que habían sido propuestos en el Méthode:
una línea recta para "las substancias que parecen entrar en la combinación
de un gran número de cuerpos"; un triángulo para "álcalis
y tierras", un semicírculo para "substancias inflamables", un círculo
para los metales, un cuadrado para los "radicales ácidos" y un rombo
para aquellas substancias cuyos componentes no eran todavía conocidos.
Como puede comprobarse en la tabla adjunta, para diferenciar a las
substancias
dentro de cada grupo propusieron el empleo de las iniciales de sus nombres
latinos. Las substancias compuestas eran designadas mediante la unión
de los símbolos de las substancias simples que las componían.
Además, para distinguir las substancias formadas por los mismos
elementos pero en diferente proporción, Adet y Hassenfratz utilizaron
la diferente posición relativa de los símbolos. De este modo,
los compuestos de oxígeno y nitrógeno eran designados con
un segmento oblicuo (nitrógeno) y otro horizontal (oxígeno)
unidos en diferentes posiciones: por el punto superior o inferior del
segmento
dispuesto oblicuamente, por el centro de ese segmento, etc.
Debido, entre otras razones, a dificultades tipográficas
para reproducir estos símbolos en los libros, su difusión
fue muy limitada. A principios del siglo XIX, la nueva notación
introducida por Jacob Berzelius, muy semejante a las modernas fórmulas
químicas, dejó en el olvido la propuesta por Adet y Hassenfratz.
